研究者ストーリー
Story教科書を書き換えた染色体研究。
全人類の宝となる、新たな知を求めて
平野染色体ダイナミクス研究室 主任研究員平野 達也 Tatsuya Hirano


教科書にあった、“分裂期染色体のブラックボックス”を解き明かしたい
染色体は、生物の遺伝情報を娘細胞へ伝える細胞内構造体である(図1)。カリフォルニア大学サンフランシスコ校(UCSF)のポスドク(博士研究員)として、その染色体を研究していた平野達也は、当時まったく知られていなかった新たなタンパク質群(現在ではSMCタンパク質と総称される)を発見した。その後、ニューヨーク郊外のコールド・スプリング・ハーバー研究所(CSHL)で研究室を主宰し、その成果を発展させた。この時期(1990年代半ばから2000年代前半)は、染色体研究分野が非常に大きな発展を遂げたばかりでなく、細胞周期との関連やヒトの遺伝病やがんとのつながりが見出されたエキサイティングな時期だ。平野によるSMCタンパク質複合体「コンデンシン」の発見は、“最後の未開拓分野における、最後の大発見”というべき成果だった。幅広い染色体機能にかかわるSMCタンパク質の機能と分子メカニズムの解析に焦点をあて、研究を進めてきた平野の足跡を辿る。
私が京都大学大学院理学研究科で研究生活を始めた1980年代前半は、分子生物学的手法が基礎的な生命現象の解明に適用され始めた時期です。しかし、ゲノム情報はまだなく、遺伝子を一つひとつ手探りで単離し、解析していかねばならない時代でした。DNA複製や転写の研究が盛んでしたが、私自身は「DNAがどのように折りたたまれているか」という基本的な問題に興味をもちました。折りたたみの第一段階であるヌクレオソームの構造が1970年代に明らかにされていたものの、それより高次段階の折りたたみ(染色体構築)の問題については、完全にブラックボックスでした。この問題に取り組んでいた数少ない研究者の一人が柳田充弘先生だったので、柳田研究室の門を叩きました。
現在の私は生化学的アプローチをとっていますが、柳田研究室では遺伝学的アプローチをとっていました。振り返ってみれば、当時は酵母遺伝学を通して、のちにコンデンシンと呼ばれることになるタンパク質複合体を探していたことになります。実際、私が単離した酵母変異株の中には、コンデンシンの変異株も存在していたことが、後に判明しました。
2つのアプローチの違いを自動車に例えてみましょう。生化学的アプローチでは、自動車を分解して各部品の機能を理解しようとします。「アクセルペダルはエンジンにつながっているので、その制御に関与しているのではないか」「ブレーキペダルはタイヤの回転を止めるために働いているのではないか」といった予想を立てます。究極的には、各部品の機能を理解したうえで、バラバラにした部品からもう一度、1台の自動車を組み上げること(再構成)ができれば、自動車が動く仕組みを理解したと実感することができます。一方、遺伝学的アプローチでは、部品を一つひとつランダムに壊して、自動車がどのように動くか(あるいは動かないか)を観察し、各部品の機能を理解しようとします。多くの場合、生化学的アプローチと遺伝学的アプローチが合流した時に、ある生命現象の総合的理解に到達します。私のコンデンシン研究も、そうした2つのアプローチの合流によって生まれた好例の一つです。
結果を生み出せなかった海外1年目。“軌道修正”が新たな発見に繋がる

京都大学大学院の博士課程修了後、平野はポスドクとしてアメリカに渡った。当時、国内にはポスドクというポジションすら存在せず、研究者が就職先を探すことは困難な時代だった。また、遺伝学的アプローチに限界を感じていた平野は、新たに生化学的アプローチの手法を求め、1989年、UCSFに留学した。当時のUCSFは、細胞生物学のメッカともいえる場所。ラボ間の垣根が低く、情報や材料の往来スピードも速いことに驚かされた。
私はUCSFで、カエル卵抽出液を用いた生化学という、新たな実験手法を学ぶことにしました。とはいえ、最初のプロジェクトは染色体構築を目指すのではなく、キネトコア(染色体上の特殊構造)を試験管内につくることを目指すもの。このプロジェクトには1年あまりを費やしたものの、何も生み出すことができませんでした。そこで、「キネトコアという特殊構造をつくるためには、まずはその土台となる染色体そのものをつくる必要があるのでないか」と考えなおし、研究を軌道修正。それが結果的にSMCタンパク質の発見につながったのですから、研究過程においてムダなことは一つもないと実感します。
私が行った、実験は次のようなものです。まずアフリカツメガエルの卵を大量に集め、それを遠心機にかけて破砕し、抽出液(卵の中身からなる高濃度のスープ)を取り出します。そこに精子核を混ぜると、試験管の中で染色体をつくることができる――というのが、この実験系の優れた点です。こうした試験管内実験系を使うと、細胞の中でつくられた染色体を単離して解析するのに比べて、様々な実験操作を容易に施すことができます。例えば、染色体を構成するタンパク質を網羅的に同定することが可能になります。そして、あるタンパク質の機能を阻害すると染色体ができなくなるということが観察されれば、そのタンパク質が染色体をつくるために必須な役割を果たしているということがわかります。こうした実験を通して、染色体構築に必須の働きを担うタンパク質「SMC2-SMC4」を発見しました。
そうした優れた成果を上げたものの、当時、海外でポスドクを終えた研究者が日本国内で独立して働くことのできる場はほとんどありませんでした。唯一の道筋としてあったのは、日本の大学の教授のもとで助手として研究の手伝いをしながら、昇進の機会を待つことくらいでしょうか。私は、ポスドク時代の仕事をアメリカで評価してもらえたので、同国にとどまり研究を発展させるために独立する――自分の研究室を主宰する――ことを選択しました。幸いCSHLからポジションのオファーをもらうことができました。研究の独立性とレベルの高い環境に期待を抱き、1995年、同研究所で自分自身の研究室を立ち上げたのです。現在では海外で研究室を主宰する日本人も増えていますが、当時はめずらしいことだったと思います。
CSHLでは、世界各国から集まる若手研究者とともに研究することの楽しさを味わいました。研究所内外の活発な交流の中で“揉まれること”により、自分自身も成長できたと感じています。研究費を獲得することは大変ですが、それ以外の雑用は少なく、研究に集中できました。そして良い仕事をすれば、それが正当に評価されるといった環境が、私の性分にも合っていました。反面、競争は大変厳しかったですね。CSHLのそうした環境下で研究を進め、1997年にSMC2-SMC4を含む新規タンパク質複合体、コンデンシンの発見に至りました。コンデンシンは、それまで誰もみたことのない奇妙なかたちをしていました(図2)。
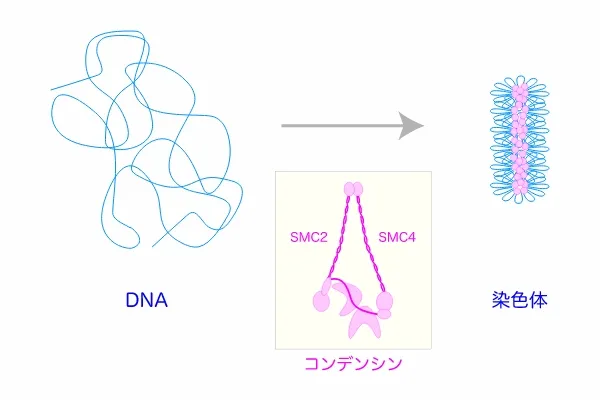
長い DNA を折りたたんでコンパクトな染色体を形成する過程(染色体構築)において、中心的な役割を果たす。
基礎生物学はもちろんのこと、ヒトの未来までも解き明かす研究領域

平野が発見したコンデンシンは、他に類を見ない新しいタイプのタンパク質機械であったため、その分子メカニズムを理解することは容易ではなかった。平野はCSHLで十数年間にわたって研究を発展させたのち、2007年に帰国。理研の中央研究所(現・開拓研究本部)に「平野染色体ダイナミクス研究室」を創設した。そして2015年、染色体の試験管内再構成に関する画期的な論文を発表した。
コンデンシンが染色体構築の中心因子であることは幅広く認められましたが、そのほかにいくつのタンパク質が必要かという問題については、わかっていませんでした。ある時、当研究室のメンバーが「限られた数の精製タンパク質を用いて染色体をつくることは可能だろうか」という問題を改めて提起してくれたので、新たな実験系を開発することを決意しました。それまでに蓄積した情報に基づいて、まず、コンデンシンを含む構造タンパク質3種類と、その働きを助けるタンパク質(シャペロンと総称される)2種類を準備しました。これら5種類のタンパク質を精子核に混ぜて、染色体の試験管内再構成を目指しましたが、うまくいきませんでした。幾多の試行を重ねたのちに、もう一つの必須シャペロンタンパク質を、ようやく同定することができました。先の5種類にこのタンパク質を加えたところ、精子核が見事に染色体に変換したことから、「わずか6種のタンパク質で染色体をつくることができる」という結論に辿り着いたのです。この結論は世界中の染色体研究者を驚かせましたが、実はその背景には1994年に発表した、SMC2-SMC4論文があるのです。すなわち、20年越しの研究成果でした。そしてこの染色体再構成は、従来の生物学の教科書を書き換えるものとして高い評価を受けました。
研究者となって以来、染色体構築という、一つの大きな目標に継続して取り組んできました。そして、研究室に集まる人材のバックグラウンドに応じて新しいアプローチを取り入れ、研究プログラムを拡大してきました。前述の染色体再構成は、その成果の一例に過ぎません。生化学、細胞生物学に加えて、構造生物学、一分子物理学、マウス遺伝学、非モデル生物の導入なども行ってきました。現在は、「分裂期染色体をつくる各部品がどのように働いているのか」、「複数の部品がどのように協調して働くのか」といった問題に焦点を絞って研究を進めています。特に、私自身が発見したコンデンシンの分子メカニズムと、その制御の理解をライフワークと位置づけています。
私たちの研究室のホームページには、「SMCタンパク質の分子メカニズム」「コンデンシンとコヒーシンによる染色体構築の制御」「染色体ダイナミクスとヒトの遺伝疾患」という3つの研究の目標が掲げられています。私たちは、基礎生物学の本質的な理解に貢献することを目指して研究を行っていますが、長期的にはがんや遺伝病といった疾患に、染色体異常がどのように関与しているかという問題を通じて、臨床医学の分野にも寄与できると期待しています。
Be original or die.――自分だけのブルーオーシャンで泳げ!

染色体の構築とダイナミクスを総合的に理解するため、研究を続けてきた平野。同研究分野が大きな発展を遂げた“第一波(1990年代半ば~2000年代前半)”と、一分子解析技術やHi-C技術などの新技術、ポリマー理論など新たな考え方が導入されて起きた“第二波(2010年代後半以降)”――そうした歴史的展開も目の当たりにしてきた。長年にわたって研究者人生を歩んできた平野の誇りとは。
私たち科学者は、「あなたの研究は何の役に立ちますか?」という質問を受けて戸惑うことが少なくありません。しかし、アスリートに対して「あなたのスポーツは何の役に立ちますか?」、小説家に対して「あなたの作品は何の役に立ちますか?」と質問する人は、いないでしょう。科学も、スポーツや小説と同じく、社会的な利益を生み出すことが第一義ではありません。それは文化であると、私は考えます。そしてそれは全人類の宝となる新たな知につながります。そうした活動の一翼を担っていることが誇りです。また、この研究分野のトップ集団で、“息も絶え絶え”になりながらも、約30年間にわたり走り続けていること――それが、もう一つの誇りです。SMCタンパク質は、今では世界中で盛んに研究されており、2017年には私が主催者の一人となってSMCタンパク質に特化した国際会議を日本で開催するまでに成長しています (図3)。

私の研究は“ザ・基礎研究”ですから、継続が何よりも大切。大きな発見は注目を浴びるきっかけにはなりますが、一発屋で終わってしまってはいけません。高いレベルで研究を継続するためには、幅広い知識と柔軟な思考力を持ち続けることが大切です。ゆえに、私の研究室のモットーは「議論、議論、議論」。丁寧な議論を踏まえて、独自の問いを立て、独自の戦略を練り、独自のアプローチを行うこと。そして競争相手との差別化を常に意識すること。これらが研究者として生き残っていくために不可欠です。「研究者はスタートアップ企業の経営者であれ!」「レッドオーシャンを目指すな。自分だけのブルーオーシャンを見つけて、思いきり泳げ!」。そうした精神を次世代の研究者に伝えていくことが、私の役目でもあります。
(文中敬称略)


